胃低级别上皮内瘤变规范化诊治专家共识(2019,北京)
一、引言
胃癌是严重威胁我国人民生命健康的重大疾病之一,其发病率和死亡率均高居恶性肿瘤的第二位[1]。
2000年,世界卫生组织(World Health Organization,WHO)消化系统肿瘤新分类引入了上皮内瘤变的概念[2]。
这一分类明确将胃黏膜上皮内瘤变根据细胞和结构的异型程度分为低级别上皮内瘤变(low grade intraepithelial neoplasia,LGIN)和高级别上皮内瘤变(high grade intraepithelial neoplasia,HGIN)。
其中,LGIN 相当于胃黏膜轻、中度异型增生。LGIN属于癌前病变,具有癌变的潜能,在临床工作中,是密切随访还是进行一定的干预措施,目前国内外均无相关共识意见。
为此,解放军总医院令狐恩强教授组织国内30余位消化、内镜、病理及相关领域的专家,参考国内外相关指南、最新进展及前期临床研究结果,通过集体讨论与投票等方式,共同制定本共识意见。
二、共识制定方法
本共识意见的具体制定采用国际通用的Delphi程序。首先成立共识意见起草小组,通过进行系统文献检索,制定共识意见草案。
文献检索采用中文数据库(中国生物医学文献数据库、万方中文期刊数据库)和英文数据库(Pubmed、Embase、Cochrane),关键词为:胃、低级别上皮内瘤变、异型增生、stomach、gastric、low grade intraepithelial neoplasia、dysplasia。随后,共识意见草案由专家委员会进行多轮讨论、修改并投票,直至达成共识。
投票意见的推荐等级(表1)与证据等级(表2)。

三、定义
上皮内瘤变(intraepithelial neoplasia, IN):是病理学诊断术语,是明确的肿瘤性病变、相当于胃黏膜的异型增生(dysplasia),即细胞形态和组织结构上与其起源的正常胃黏膜组织存在不同程度的不典型性(atypia)。
其特征是一种形态学上以细胞和结构异常、遗传学上以基因克隆性改变、生物学行为上有进展为具有侵袭和转移能力的浸润性胃癌为特征的癌前病变。根据细胞和腺体结构异型增生的程度分为 LGIN 和HGIN,其中LGIN相当于轻、中度异型增生。
四、LGIN的转归及规范化内镜下评估
胃黏膜LGIN进展缓慢,国外的研究显示,约38%~75%的患者可发生逆转,异型性消失;19%~50%的患者病变长期维持不变;仅少数发展为进展期胃癌[3]。
另一项更早的研究则显示,在随访的10~48个月内约0~23%的LGIN患者发生了癌变,每年胃癌的进展率为0.6%左右[4]。而国内一项最长达10年临床随访的大样本研究显示,约51.0%~78.7%的LGIN患者可发生逆转,另有约0.45%~14.3%的患者则发生癌变[5]。
由此可见,LGIN长期临床转归有两种结局,部分有病变的潜力,故而对临床处理造成困扰。什么情况下需要监测,什么情况下需要积极干预,还需要进一步探讨。
近期有国外文献报道,内镜下活检病理诊断的LGIN病变大小超过2 cm是提示最终病理升级的独立危险因素(OR:3.27,95%CI:1.28~8.39)[6-7],而表面形态呈现出Paris分型[8]中的0-Ⅱc及 0-Ⅲ型、表面色泽出现红斑及表型糜烂的LGIN病变,也提示存在最终病理升级的可能。
2016年的一项研究则显示,在放大内镜(magnifying endoscopy,ME)结合窄带成像技术(narrow-band imaging,NBI)的观察下,若LGIN病变具有明确的边界,并且其表面微结构中的腺管开口形态和(或)微血管形态存在异常,即提示存在最终病理升级的可能[9]。
因此,我们建议对所有活检病理诊断为LGIN病变,均应再次进行规范化的内镜下的精细评估,具体包括:病变大小、表面形态、表型及色泽,特别是应用ME+NBI对于病变边界和表面微结构(必要时可结合色素内镜,如靛胭脂、醋酸等)进一步观察。
若病变>2 cm和/或存在明确边界且表面微结构存在异常,提示最终有病理升级可能,应视为LGIN中的高危因素,有必要进行内镜下干预治疗。
LGIN具有一定的癌变潜力,应进行规范化的内镜下精细评估。(推荐级别:A+:83.3%,A:10%,A-:6.7%;证据等级:中等质量)。
若LGIN病变>2 cm和/或存在明确边界且表面微结构存在异常,提示最终有病理升级可能,应视为LGIN中的高危因素(推荐级别:A+:60%,A:26.7%,A-:13.3%;证据等级:低质量)。
五、LGIN的临床管控
胃LGIN随访观察或积极进行内镜下干预的目的是及时阻断病变的进展,另一方面,也防止因活检病理诊断的局限性等造成对整体病变评估不足所导致的误诊。
基于前述对于LGIN的转归及规范化内镜下评估内容的阐述以及近年来部分文献对于LGIN处置方法的建议[10],我们推荐以下管理措施:
(一)对于存在病理升级高危因素的LGIN,建议3个月后再次内镜精细评估及精准活检。
1.若再次活检病理诊断为HGIN或早期胃癌,建议参考《早期胃癌内镜下规范化切除的专家共识意见(2018,北京)》[11]相关内容(推荐级别:A+:96.7%,A:3.3%;证据等级:中等质量)。
2.若再次活检病理仍诊断为LGIN,建议行内镜下诊断性完整切除(推荐级别:A+:30%,A:43.3%,A-:16.7%;证据等级:低质量)。
此外,欧洲指南推荐[12],对于合并幽门螺杆菌(Helicobacter pylori,Hp)感染的LGIN,应于内镜下诊断或治疗后进行根除。另有国外相关文献报道,根除Hp可减少LGIN切除后复发的机率,且根除Hp可在一定程度上改变进展为胃癌的过程[13-14]。
因此,对于内镜下存在病理升级高危因素的LGIN,若合并Hp感染,建议于内镜下完整切除后根除Hp(推荐级别:A+:50%,A:33.3%,A-:13.3%;证据等级:低质量)。
(二)对于暂不存在病理升级高危因素的LGIN,仍建议在初次发现LGIN3个月后再次内镜精细检查并对可疑病变处再次活检。此外,如合并有Hp感染,建议先行根除Hp治疗[12]。
1.对于无高危因素的胃LGIN,若再次活检病理诊断无LGIN存在,建议1年后胃镜复查[13](推荐级别:A+:36.7%,A:43.3%,A-:13.3%;证据等级:低质量)。
2.对于无高危因素的胃LGIN,若再次活检病理仍诊断为LGIN,推荐行内镜下毁损治疗或胃镜密切随访;其中内镜下黏膜毁损治疗方法,包括射频消融治疗(radiofrequency ablation,RFA)和氩离子凝固术(argon plasma coagulation,APC),胃镜密切随访间期为3个月[14](推荐级别:A+:26.7%,A:26.7%,A-:30%;证据等级:低质量)。
(1)射频消融治疗(radiofrequency ablation,RFA):射频消融的原理是通过高频交流电的作用引起组织内的带电粒子运动产生热量,从而使细胞内外水分蒸发、干燥、固缩脱落以致无菌性坏死。
Baldaque-Silva等[15]在2013年首先进行了3例胃异型增生的治疗,随访18个月,无异型增生复发。2015年,Leung等[16]报道对4例胃LGIN进行射频治疗,结果病变都成功消除,治疗过程中无出血、穿孔等并发症发生。
国内令狐恩强教授于2014年10月首先开展了胃LGIN的治疗研究,其治疗有效率达91.3%,且无严重并发症的发生[17]。另外,令狐恩强教授团队在随后的一项大样本研究中,对比分析了RFA 115例和内镜下黏膜剥离术(endoscopic submucosal dissection,ESD)126例治疗胃LGIN的疗效和安全性。
结果显示:(1)RFA治疗LGIN的短期有效率与ESD相比无明显差异(93.9% vs 94.4%,P>0.05);(2)术后12个月复发率RFA组略高于ESD治疗组(4.8% vs 1.4%,P=0.031);(3)在严重并发症发生率、瘢痕的发生率、手术时间及住院天数等方面,RFA组明显优于ESD[18-19]。
内镜下RFA治疗胃黏膜病变的特点:与其他方法相比,每一次毁损覆盖面积较大,作用面深度较一致;器械接触面不产生焦痂,对周围黏膜无损伤;电流传输不通过全身,无辐射,对神经肌肉无兴奋刺激作用,一般不会诱发心血管意外,安全性高;无烟雾、视野清晰、可操作性好。
RFA操作前评估:
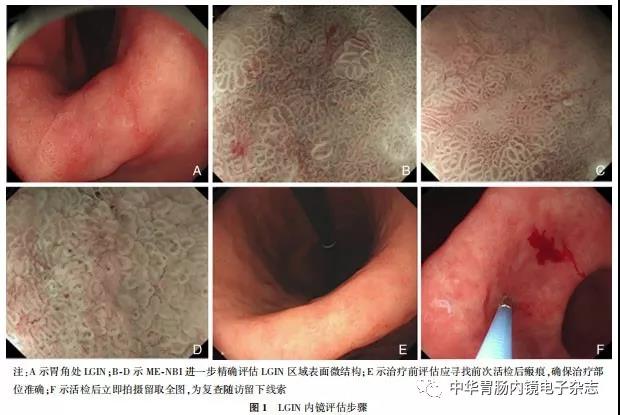
RFA操作前,建议常规使用GIF-H260Z胃镜再次对上消化道进行细致全面的检查,特别是胃内提示LGIN病变处,要进行仔细评估,并保证内镜留图的数量和质量(图1A~D),必要时进行染色内镜下放大评估,并建议在RFA治疗前于LGIN病变较重处再次取材活检(图1E、1F),如病变较大,一般单处病变超过1 cm时,建议标记病变边界,确保射频部位准确。
操作方法:
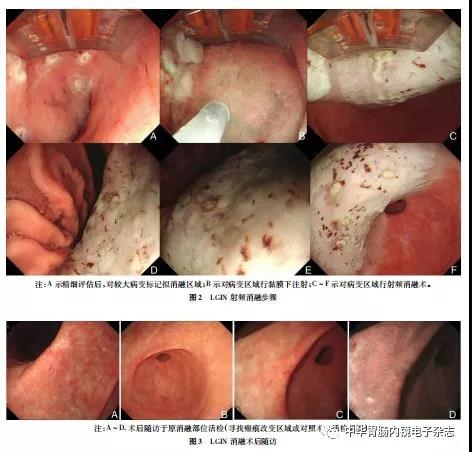
完成放大胃镜精查后,撤出内镜,在体外于内镜头端安装射频消融电极片,进镜对病变区域黏膜行射频消融治疗,射频消融后病灶表面凝固坏死、颜色变白(图2A~F)。
一次烧灼完成后再进行下一次烧灼前,清除表面已凝固坏死组织,胃部病变重复消融3次,功率57W,能量密度15 J/cm2,观察确定消融效果,明确无活动性出血后,退镜。
操作后处理:
如无特殊并发症发生,术后禁食1 d后进食流食,3 d后进食半流食,后逐渐过渡至正常饮食,并给予口服质子泵抑制剂(proton pump inhibitor,PPI)、胃黏膜保护剂等药物。
疗效判断:
术后3个月进行胃镜检查,依据在原治疗部位活检的病理结果为判断疗效的标准(图3A~D)。
术后复查病理如为阴性,可于1年后再复查内镜;如复查病理提示仍为LGIN,可建议患者再次接受治疗或者间隔3个月再次密切随访;如果复查病理提示为HGIN,建议补充ESD治疗(图5)。
补充说明:
对于RFA治疗前所取的活检,目的是于术前再次确认,个别患者如手术后病理回报为HGIN,建议补充ESD治疗。
解放军总医院9例RFA后追加ESD治疗,治疗过程中仅有报轻度的粘连,未发现RFA会影响病变部位再次ESD治疗(未发表)。
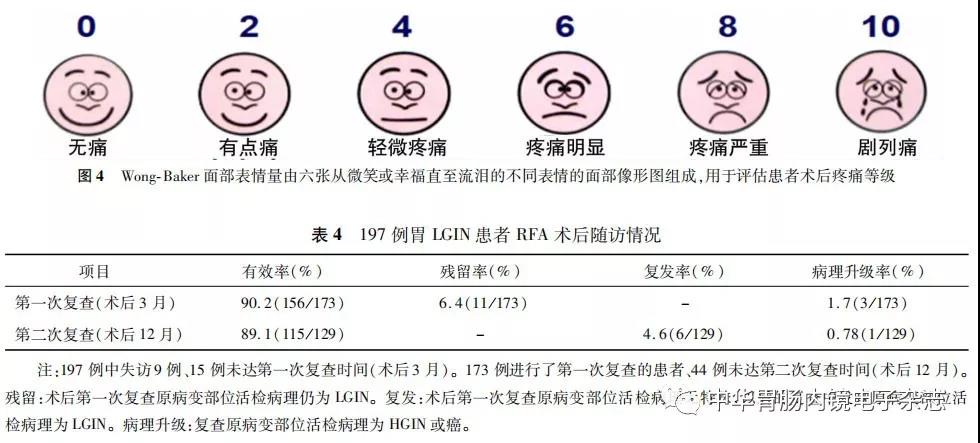
术后并发症:RFA术后的主要并发症仅有少数患者出现腹痛、出血和穿孔,发生率低。研究显示,以Wong-Baker面部表情量表作为疼痛评分依据(图4、表3),术后并发腹痛评分多为2~6分,以术后1~8 d为疼痛高峰期[20]。
令狐恩强教授团队的一项研究显示[21],黏膜下注射液体垫有助于缓解疼痛:术后1周,无黏膜下注射组62.3%的患者为B级以上疼痛,而黏膜下注射组78.9%的患者为A级疼痛;术后2周,疼痛程度逐渐缓解,无黏膜下注射组半数以上患者表现为A级疼痛,而黏膜下注射组则可达89.4%。
患者疼痛多在口服抑酸剂、胃黏膜保护剂等药物治疗后缓解,考虑与射频治疗造成黏膜轻度损伤有关。

RFA治疗时,对消融区域是否要进行黏膜下注射,目前尚无明确的对照研究数据。我们前期的研究显示,RFA术后1个月复查胃镜,无黏膜下注射组与黏膜下注射组的总瘢痕形成率(56.4% vs 56.3%)及完全愈合率(43.6% vs 43.8%)相当,但无黏膜下注射组以红色瘢痕形成为主(40%),
黏膜下注射组以白色瘢痕形成为主(37.5%)[21]。因此,黏膜下注射液体垫在胃LGIN毁损过程中,在维持治疗效能的同时,可发挥保护黏膜下层及固有肌层的作用,减轻患者术后疼痛,促进组织愈合,减少瘢痕的形成及纤维性粘连,降低对日后追加ESD治疗的不利影响。
此外,对于一些特殊部位,如胃角、胃体小弯等部位,黏膜下注射后病变隆起,可与电极片贴合更紧密,更利于操作。
(2)氩离子凝固术(argon plasma coagulation,APC):APC是一种非接触毁损方法,其原理是将离子化的氩气喷射到靶黏膜,从而将高频电能传递到组织,使其在高温的条件下凝固。
国外文献报道,APC治疗早期胃癌及胃异型增生的短期局部复发率为4%~10%[22-23];而国内的研究则显示,APC术后1个月的复查结果提示其治疗有效率为81.8%[24]。
另有回顾性研究表明,APC与ESD相比较,其复发率高于ESD组(3.8%,4/106 vs 0.5%,1/188,P=0.036),但是,所有患者通过追加APC治疗并随访无进一步复发[25]。
虽然ESD治疗的有效率高,但其并发穿孔、出血高于APC组,且操作时间也明显长于APC组(53.1±38.1)min vs (7.8±5.1) min),P<0.01。
目前尚无关于APC与RFA治疗胃LGIN疗效差异对比的相关临床研究,但根据现已报道的二者治疗效果来看[17-19,24],RFA略优于APC。APC的喷射消融与RFA的贴合消融相比,可能存在消融处深浅不一致,这也可能是导致较大病变残留或复发的重要原因,从而导致治疗有效率下降。
同时,基于上述内容,APC还存在着对于黏膜下层及固有肌层的进一步破坏、加重瘢痕粘连致创面愈合延缓或追加ESD治疗时操作难度加大、增加并发穿孔风险等不足之处。
3.对无高危因素的胃LGIN,若3个月后再次活检病理诊断为HGIN或早期胃癌,建议参考《早期胃癌内镜下规范化切除的专家共识意见(2018,北京)》相关内容(推荐级别:A+:83.3%,A:16.7%;证据等级:中等质量)。
六、胃LGIN治疗后随访监测
目前国内外关于LGIN内镜下治疗术后的随访时间间隔尚无明确定论,这方面的文献报道也很有限[11-12,26]。为此,令狐恩强教授团队回顾分析了解放军总医院197例术前诊断为胃LGIN的患者接受RFA治疗后随访情况(表4),在第一次复查(术后3个月)时,有11例残留、3例病理升级。
在第二次复查(术后12个月)时,有6例复发、1例病理升级。2次复查共有17例残留或复发的患者,其中8例追加了RFA/APC治疗、6例追加ESD、3例未追加治疗继续随访;4例病理升级的患者均追加ESD或外科手术治疗(未发表)。这些数据对于LGIN随访时间的选择和干预措施的应用有着重要的参考价值。
(一)接受内镜下完整切除术患者的随访建议
1.若完整切除的标本术后病理证实为HGIN或早期胃癌的患者,随访意见建议参考《早期胃癌内镜下规范化切除的专家共识意见( 2018,北京)》[11]相关内容(推荐级别:A+:76.7%,A:23.3%;证据等级:中等质量)。
2.若术后病理证实仍为LGIN的患者,建议在术后1年再次复查胃镜[12](推荐级别:A+:50%,A:46.7%,A-:3.3%;证据等级:低质量)。
(1)若1年后随访的活检病理诊断无LGIN,可认为完全治愈(推荐级别:A+:50%,A:46.7%,A-:3.3%;证据等级:低质量)。
(2)若1年后治疗部位的随访活检病理诊断为LGIN,建议再次参考前述管控流程(推荐级别:A+:50%,A:46.7%,A-:3.3%;证据等级:中等质量)。
(二)接受内镜下毁损患者的随访建议
建议术后3个月复查胃镜,在治疗部位活检复查病理,依据病理结果制定随访监测计划。
1.若活检病理诊断无LGIN,建议1年后胃镜复查[12](推荐级别:A+:50%,A:16.7%,A-:26.7%;证据等级:低质量)。
2.若活检病理诊断为LGIN,建议患者可接受再次黏膜消融治疗,或参见前述LGIN处理流程密切监控(推荐级别:A+:40%,A:50%,A-:10%;证据等级:中等质量)。
3.若活检病理诊断为HGIN,随访意见建议参考《早期胃癌内镜下规范化切除的专家共识意见(2018,北京)》[11]相关内容(推荐级别:A+:86.7%,A:13.3%;证据等级:中等质量)。
(三)未行内镜下治疗的胃LGIN患者的随访监测建议
建议3个月后胃镜复查。
1.若活检病理诊断无LGIN,建议1年后胃镜复查[12](推荐级别:A+:33.3%,A:40%,A-:26.7%;证据等级:低质量)。
2.若活检病理诊断仍为LGIN,建议参见前述胃LGIN管控流程3个月后再次密切随访,或建议患者接受内镜下毁损治疗(推荐级别:A+:23.3%,A:33.3%,A-:26.7%;证据等级:低质量)。
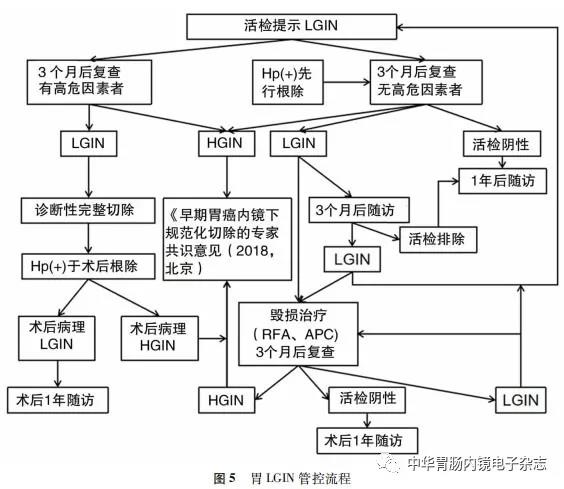
七、胃LGIN的管控流程图(图5)

基金项目:北京市科委重大项目(D141100000414003)
作者单位:100853 北京,解放军总医院第一医学中心消化内科
通信作者:令狐恩强,Email:linghuenqiang@vip.sina.com
执笔:柴宁莉、李惠凯、翟亚奇、王楠钧、李贞娟、李佳、王赞滔
单位:解放军总医院第一医学中心消化内科
专家组成员名单:略
参考文献(略)


